Например, оксид алюминия реагирует с гидроксидом натрия в расплаве, образуя глинозем натрия и воду:
Способ получения алюминия электролизом суспензии глинозема в расплаве алюминия Российский патент 2021 года по МПК C25C3/06
Современный процесс производства алюминия (процесс Эру-Холла) не претерпел принципиальных изменений за более чем 100 лет своего существования. Она характеризуется низкой удельной производительностью (около 1 кг/м 2 ч), высоким потреблением энергии и, прежде всего, плохим экологическим балансом. На протяжении многих лет проводились многочисленные исследования, направленные на совершенствование существующей технологии и разработку альтернативных методов производства алюминия. Наиболее передовыми были карботермический метод и неклассические процессы электролиза (электролиз хлоридных и фторидных расплавов при низкой температуре с вертикальными «инертными» (малопотребляющими) электродами). В настоящее время наиболее важным промышленным процессом производства алюминия является электролиз криолитового расплава, содержащего растворенный глинозем, при температуре 940-970°C. Этот метод был открыт в 1886 году и назван в честь его изобретателей. Процесс Эру-Холла осуществляется в электролитах со связанными или самообжигающимися углеродными анодами, которые сгорают до оксидов углерода в результате восходящего окисления ионов кислорода, содержащихся в расплаве.
Также известен процесс (US 5006209, C25C 3/06, опубл. 09.04.1991), в котором алюминий получают путем пропускания электрического тока между катодом и анодом в суспензии мелких частиц глинозема в низкотемпературных (значительно ниже 950 °C) фторидных расплавах. Процесс происходит в электролите, который имеет ряд вертикальных неконсумируемых анодов и ряд вертикальных катодов. Газогенератор, прикрепленный ко дну электролита, производит взвешенные частицы глинозема. Концентрация глинозема в суспензии составляет от 2 до 30 % (масс./масс.).
Известен также патент RU 2274680, C25C 3/06, опубликованный 20.04.2006, на способ получения металлов электролизом расплавленных солей, который получен в качестве прототипа.
В данном патентном источнике описан процесс восстановления металлов электролизом суспензии оксидов металлов в расплавленных солях, при котором электрический ток протекает между катодом и анодом, причем содержание оксидов металлов в расплавленных солях выбирается в диапазоне, обеспечивающем эффективное разделение межэлектродных промежутков и исключающем конвекцию в зазоре между электродами, и составляет 10-60 к. б. % температура электролиза поддерживается выше температуры ликвидуса солей, кристаллизующихся на электродах, что позволяет избежать пассивации солей на поверхности электродов и обеспечить высокую плотность тока. Дисперсионная среда суспензии оксида металла представляет собой фторидный, фторидно-хлоридный или хлоридный расплав электролита, и металл, особенно алюминий, выделяется на катоде, а газ, особенно кислород, выделяется на аноде вдоль внешней и внутренней поверхностей электрода.
Этот метод обеспечивает эффективное разделение продуктов электролиза при малых расстояниях между электродами (0,5-2 см) и высокую энергоэффективность процесса. Техническим результатом является устранение конвенции в электродном зазоре и пассивации поверхности электрода солями, а также создание эффективного разделения катодного и анодного пространства и увеличение плотности тока. Недостатком способа является использование суспензии оксида металла с фторидным электролитом, фторидно-хлоридным расплавом или хлоридным расплавом для получения дисперсионной среды. Эти хлориды и фториды являются источниками экологических проблем, вредных для человека и природы в целом.
Похожие патенты RU2745830C1
- Зайков Юрий Павлович
- Ковров Вадим Анатольевич
- Крюковский Василий Андреевич
- Храмов Андрей Петрович
- Шуров Николай Иванович
- Крюковский Василий Андреевич
- Сиразутдинов Геннадий Абдуллович
- Поляков Петр Васильевич
- Симаков Дмитрий Александрович
- Горланов Евгений Сергеевич
- Симаков Дмитрий Александрович
- Гусев Александр Олегович
- Поляков Петр Васильевич
- Попов Юрий Николаевич
- Делькло Кристиан
- Боннардель Оливье
- Абакумов Артем Михайлович
- Алексеева Анастасия Михайловна
- Антипов Евгений Викторович
- Васильев Сергей Юрьевич
- Иванов Виктор Владимирович
- Хасанова Нелли Ракиповна
- Цирлина Галина Александровна
- Пингин Виталий Валерьевич
- Симаков Дмитрий Александрович
- Маракушев Алексей Александрович
- Моисеенко Валентин Григорьевич
- Римкевич Вячеслав Сергеевич
- Маловицкий Юрий Николаевич
- Крюковский Василий Андреевич
- Сиразутдинов Геннадий Абдуллович
Реферат патента 2021 года Способ получения алюминия электролизом суспензии глинозема в расплаве алюминия
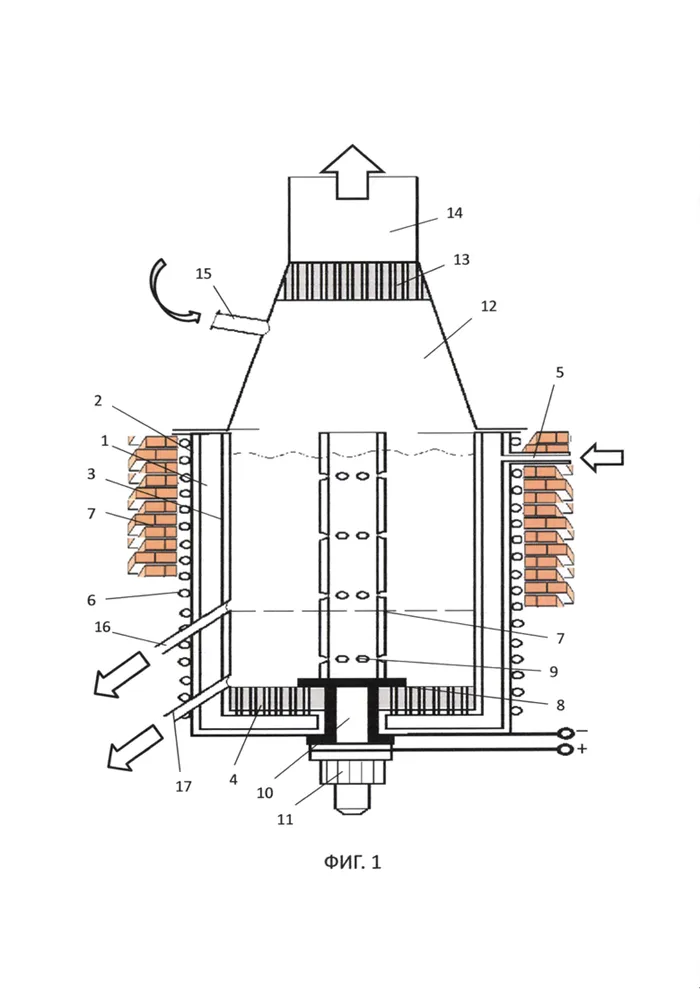
Изобретение относится к способу получения алюминия путем электролиза электролита в виде суспензии глинозема в расплаве алюминия. Процесс включает прохождение электрического тока через электролит между катодом и нерасходуемым анодом, получение расплава суспензии глинозема в глиноземном расплаве с соотношением глинозема 40-45 мас. % от объема объединенной ванны и электролиз со свинцом при температуре 700-750 °C и постоянном токе между катодом и неконсервируемым анодом 200 А, образуя распределенный катод в виде расплава глинозема в ванне с электролитом, при барботировании суспензии в газовой ванне с азотом для обеспечения однородного распределения частиц глинозема в расплаве глинозема, и регулируя состав электролита путем подачи порций глинозема в электролит для уменьшения содержания Al2O3/Al = 2-40 % масс. Упрощает процесс производства алюминия, повышая его экологичность и безопасность. 1 илл.
Процесс получения алюминия путем электролиза электролита в виде суспензии глинозема в ванне расплавленного алюминия, в котором электрический ток протекает в электролите между катодом и неконсервируемым анодом, характеризующийся тем, что получают суспензию глинозема в ванне расплавленного алюминия в соотношении глинозема 40-45 мас. % от общего объема ванны, и электролиз проводят при температуре 700-750°C и постоянном токе 200 А между катодом и неконсервируемым анодом, формируя распределенный катод в виде расплава глинозема в ванне с электролитом, при этом проливая суспензию в ванне с газообразным азотом для обеспечения однородного распределения частиц глинозема в расплаве глинозема и корректировки состава электролита путем осаждения частиц глинозема в электролит для получения Al2O3/Al = 2-40 мас.%.
Алюминий
Алюминий — самый распространенный металл в земной коре. Свойства алюминия позволяют активно использовать его в металлических конструкциях: Он легкий, мягкий, ковкий и обладает высокой коррозионной стойкостью.
Алюминий характеризуется высокой химической активностью и обладает высокой электро- и теплопроводностью.

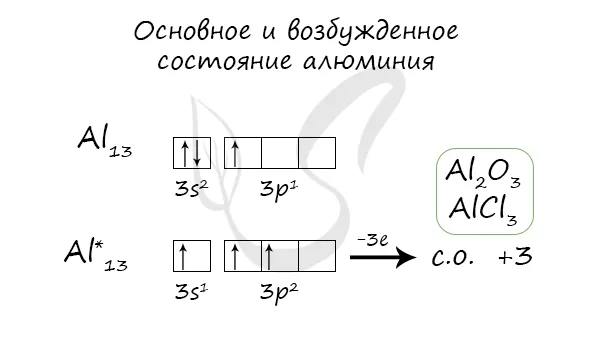
Основное и возбужденное состояния
Когда атом алюминия переходит в возбужденное состояние, 2 электрона в s-подуровне испаряются, а один электрон переходит в p-подуровень.
Физические соединения
- Al2O3— корунд
- 3BeO*Al2O3*6SiO2— Бериллий (аквамарин — примеси Fe и изумруд — примеси Cr)2O3)
- Al2O3*Cr2O3— красный рубин
- Al2O3с примесью Fe +2 /Fe +3 /Ti
- Al2O3*H2O — боксит

Получить
Алюминий производится путем электролиза расплавленного Al2O3в криолите (Na3AlF6Галлий, индий и таллий аналогичным образом получают электролизом их оксидов и солей.
Химические свойства
Реагирует с галогенами (кроме фтора) и кислородом при комнатной температуре с образованием оксидного слоя.
Al + Br2→ AlBr3(бромид алюминия)
При нагревании алюминий вступает в реакцию с фтором, серой, азотом и углеродом.
Al + F2→ (t) AlF3(фторид алюминия)
Al + S → (t) Al2S3(сульфид алюминия)
Al + N2→ (t) AlN (нитрид алюминия)
Al + C → (t) Al4C3(карбид алюминия)

Алюминий является амфотерным (в переводе с греческого «оба» — двойной) и реагирует как с кислотами, так и с основаниями.
Al + NaOH + H2O → NaAl(OH)4+ H2↑ (тетрагидроксиалюминат натрия; поскольку алюминий дается в чистом виде, выделяется водород).
При прокаливании сложные соли не образуются, так как вода испаряется, но (в рамках ЕГЭ) образуются средние соли — соли алюминия (академические — сложные оксиды):
Он не работает при комнатной температуре, потому что образуется слой оксида — Al2O3— комнатной температуре, образуя оксидный слой на воздухе. Если оксидный слой может быть разрушен нагреванием щелочного раствора или амальгамированием (покрытие металла слоем ртути), реакция продолжается.

Алюминотермия (лат. aluminium + греч. therme — тепло) — процесс получения металлов и неметаллов, включающий восстановление их оксидов алюминием. Процесс может достигать температуры до 2400°C.
Термализм алюминия используется для получения Fe, Cr, Mn, Ca, Ti, V и W.

Оксид алюминия
Оксид алюминия образуется в результате реакции с кислородом — на воздухе алюминий покрывается оксидным слоем. При нагревании гидроксид алюминия легко разлагается на оксид и воду как нерастворимое основание.
Получение алюминия электролизом
Электролитическое восстановление оксида алюминия, растворенного в расплаве на основе криолита, проводится при температуре 950-970°C в электролите. Электролит состоит из ванны, выложенной углеродными блоками, по дну которой пропускается электрический ток. Выделяющийся в основании жидкий алюминий, который служит катодом, тяжелее расплавленной соли в электролите и поэтому концентрируется в угольном слое, из которого его периодически откачивают (Рисунок 4). Угольные аноды погружаются в электролит и сгорают с выделением кислорода из оксида алюминия, производя монооксид углерода (CO) или диоксид углерода (CO2На практике используются два типа анодов:
- самообжигающиеся аноды Зедерберга, состоящие из брикетов, так называемых «хлебов» массы Зедерберга (малозольный уголь с 25 – 35 % каменноугольного пека), набитых в алюминиевую оболочку; под действием высокой температуры анодная масса обжигается (спекается);
- обожженные, или «непрерывные», аноды из больших угольных блоков (например, 1900 × 600 × 500 мм массой около 1,1 т).
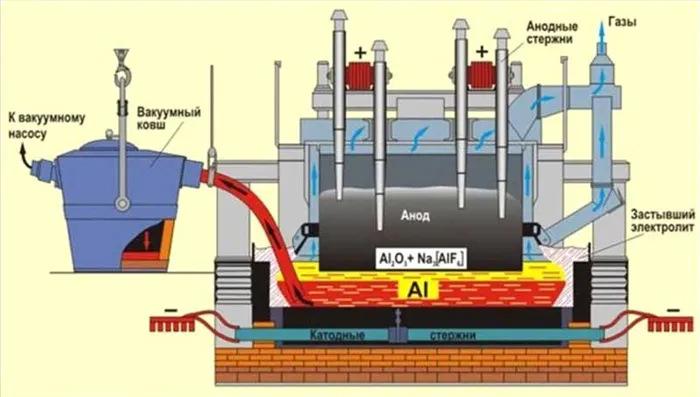
Рисунок 4 — Схематическая диаграмма электролита.
Номинальный ток электролитов составляет 150 000 A. Они соединяются последовательно, т.е. образуется система (ряд) длинных рядов электролитов.
Рабочее напряжение ванны 4 — 5 В значительно выше напряжения, при котором происходит разложение оксида алюминия, поскольку во время работы неизбежны потери напряжения в различных частях системы. Баланс сырья и энергии для производства 1 тонны алюминия показан на рисунке 5.
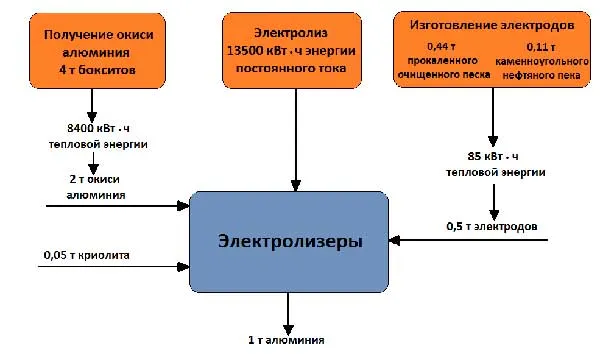
Рисунок 5 — Сырьевой и энергетический баланс для производства 1 тонны алюминия
В реакционном сосуде оксид алюминия сначала превращается в хлорид алюминия. Затем следует электролиз AlCl3растворяется в расплавленной KCl соли NaCl. Образующийся хлор поглощается и перерабатывается; алюминий отделяется в катоде.
Преимущества этого метода по сравнению с предыдущим электролизом жидкого криолит-глиноземного расплава (A2O3растворенный в Na3AlF6) являются: Экономия энергии до 30 %; возможность использования глинозема, непригодного для обычного электролиза (например, Al2O3с высоким содержанием пирита); замена дорогостоящего криолита более дешевыми солями; устранение риска выбросов фтора 7.
Получение рафинированного алюминия
Для алюминия рафинирующий электролиз с водным раствором соли невозможен. Поскольку чистота промышленного алюминия (Al 99,5 — Al 99,8), получаемого электролизом криолитовых алюминиевых заводов, недостаточна для некоторых целей, еще более чистый алюминий (Al 99,99 R) получают из промышленного алюминия или металлических отходов путем рафинирования. Наиболее известным процессом рафинирования является трехслойный электролиз.
Рафинирование методом трехслойного электролиза
Рафинировочная ванна со стальной футеровкой, работающая на постоянном токе (рис. 6), состоит из угольного слоя с токопроводами и теплоизолирующей магнезитовой футеровки. В отличие от электролиза криолито-глиноземного расплава, анодом обычно является расплавленный рафинированный металл (нижний анодный слой). Электролит состоит из чистых фторидов или смеси хлорида бария и фторидов алюминия и натрия (средний слой). Алюминий, растворенный из анодного слоя в электролите, высвобождается над электролитом (верхний катодный слой). Чистый металл служит катодом. Ток подается на катодный слой через графитовый электрод.
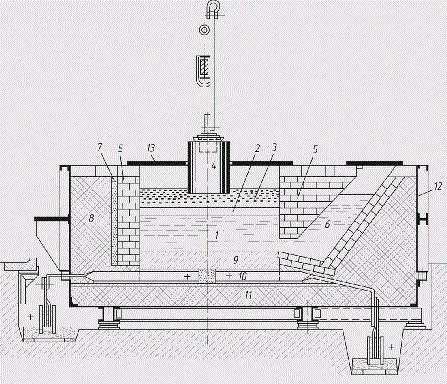
Рисунок 6 — Схема электролизера с предкамерой для рафинирования алюминия (по Фульде — Гинзбергу).
1 — расплав алюминия; 2 — электролит; 3 — высокочастотный рафинированный алюминий; 4 — графитовый катод; 5 — магнетитовая стенка; 6 — передняя шейка; 7 — изоляционный слой; 8 — боковая изоляция; 9 — углеродный слой; 10 — анодный токопровод; 11 — изоляция слоя; 12 — железный ящик; 13 — крышка
Резервуар работает при температуре 750 — 800 °C, расход энергии составляет 20 кВт/ч на 1 кг чистого алюминия, что несколько выше, чем при обычном электролизе алюминия.
Анодный металл содержит 25-35 % Cu, 7-12 % Zn, 6-9 % Si, до 5 % Fe и небольшое количество марганца, никеля, свинца и олова; остальное (40-55 %) — алюминий. Все тяжелые металлы и кремний остаются в анодном слое во время рафинирования. Присутствие магния в электролите приводит к нежелательным изменениям в составе электролита или к сильному шлакованию. Для удаления магния из шлака магнийсодержащий шлак обрабатывается флюсом или газообразным хлором.
При рафинировании получается чистый алюминий (99,99 %) и продукты разделения, содержащие тяжелые металлы и кремний (продукт Зейгера), которые выделяются в виде щелочного раствора и кристаллического остатка. Щелочной раствор является отходом, а твердый остаток используется для раскисления.
Рафинированный алюминий обычно имеет следующий состав в %: Fe 0,0005 — 0,002, Si 0,002 — 0,005, Cu 0,0005 — 0,002, Zn 0,0005 — 0,002, следы Mg, баланс Al.
Рафинированный алюминий перерабатывается в полуфабрикат с заданным составом или в сплав с магнием (табл. 1).
Таблица 1 — Химический состав сверхчистого алюминия и первичного алюминия в соответствии с DIN 1712, лист 1
Соли алюминия
Нитрат и сульфат алюминия
При нагревании нитрат алюминия разлагается на оксид алюминия, оксид азота (IV) и кислород:
Сульфат алюминия разлагается на оксид алюминия, диоксид серы и кислород:
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксиалюминатов алюминия — полезен следующий метод: Тетрагидроксиалюминат мысленно разлагается на две отдельные молекулы — гидроксид алюминия и гидроксид щелочи.
Например, мы разделили тетрагидроксиалюминат натрия на гидроксид алюминия и гидроксид натрия:
NaAl(OH)4NaOH и Al(OH)3
Свойства всего комплекса могут быть определены как свойства этих отдельных соединений.
Таким образом, гидроксильные комплексы алюминия реагируют с кислотными оксидами.
Например, гидроксильный комплекс разрушается под действием избытка углекислого газа. В то же время он вступает в реакцию с CO2реагирует с NaOH с образованием кислой соли (в избытке CO2), тогда как амфотерный гидроксид алюминия не реагирует с углекислым газом и поэтому просто выпадает в осадок:
Тетрагидроксиалюминат калия аналогично реагирует с углекислым газом:
По тому же принципу тетрагидроксиалюминаты реагируют с диоксидом серы SO2:
Однако под воздействием избытка сильной кислоты осадок не выпадает, поскольку амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например, с соляной кислотой:
Однако под воздействием небольшого количества (недостаточно) сильной кислоты осадок все равно выпадает, поскольку кислоты недостаточно для растворения гидроксида алюминия:
Аналогичным образом, гидроксид алюминия выпадает в осадок в отсутствие азотной кислоты:
Комплекс разлагается при контакте с водой, содержащей хлор (водный раствор хлора) Cl2:
хлор в этом случае непропорционально велик.
Комплекс также может реагировать с избытком хлорида алюминия. Это приводит к выпадению осадка гидроксида алюминия
Если из раствора комплексной соли выпарить воду и нагреть полученное вещество, то останется обычная соль алюминия:
Гидролиз солей алюминия
Растворимые соли алюминия и сильные кислоты гидролизуются под действием катиона. Гидролиз протекает поэтапно и является обратимым, т.е. незначительно:
Стадия I: Al 3+ + H2O = AlOH 2+ + H +
Стадия II: AlOH 2+ + H2O = Al(OH )2+ + H +
Однако сульфиды, сульфаты, карбонаты алюминия и их кислые соли полностью и необратимо гидролизуются, т.е. они не существуют в водном растворе, а разлагаются в воде:
Для получения дополнительной информации о гидролизе см. соответствующую статью.
Алюминаты
Соли, в которых алюминий является кислотным остатком (соли алюминия), образуются из оксида алюминия при его сплавлении со щелочами и основными оксидами:
Концентрированное электричество
В лаборатории электролиза алюминиевого литейного завода имеются сотни электролитов. Каждый из них довольно прост: стальная ванна, которая является катодом (отрицательным электродом), заполняется горячим криолитовым расплавом температурой 950 °C, в котором растворен оксид алюминия (глинозем). Анод (положительный электрод) погружается в расплав. Через электролит проходит ток, выделяя кислород на аноде и алюминий на катоде, который в жидком виде покрывает дно ванны (температура его плавления составляет 660 °C). «Наши инженеры шутят, что алюминий — это конденсированное электричество, — объясняет Виктор Манн, технический директор UC RUSAL, — для производства одного килограмма металла требуется 13 кВт/ч электроэнергии. Раньше он был намного выше, но благодаря усовершенствованию технологий мы смогли его снизить — и, надеюсь, сможем снизить его еще больше. Это одна из тех вещей, над которыми мы работаем: Снижение потребления электроэнергии за счет оптимизации анодов, электролита, снижения тепловыделения и других факторов.
Другой проблемой является использование электроэнергии. В электролизере сотни электролитических конденсаторов соединены последовательно, каждый из которых имеет очень маленькое падение напряжения — всего 4 В. Но ток измеряется в сотнях килоампер (конкретно 320 кА для КАЗ и 550 кА для более новых электролитических конденсаторов). Такие токи, протекающие по близлежащим проводникам, вызывают амперную силу, которая приводит к силам в сотни и тысячи килоампер, действующим на проводники тока. Чтобы минимизировать влияние силы ампера, конструкция проводников и самих электродов должна быть рассчитана с помощью компьютерных моделей, — объясняет Виктор Манн, — конфигурация сложная, нужно распределить кабели к анодам по высоте и длине, учесть размер передающих стержней, длина которых составляет несколько десятков метров, чтобы магнитные поля не исказили всю конструкцию. Силы действуют и на расплавленный алюминий, который покрывает дно ванны слоем толщиной 20-50 см и также служит проводником электричества.
Аноды и катоды
При производстве алюминия расходуется не только электроэнергия, но и углеродные аноды. Поскольку материал анода должен противостоять электрической коррозии (растворению в электролите и в алюминии), в настоящее время в качестве такого материала используется углерод. Однако он довольно быстро сгорает под воздействием выделяющегося кислорода, образуя угарный газ и углекислый газ: Для производства одной тонны алюминия расходуется около полутонны углеродных анодов.
Существует два основных типа угольных анодов. Непрерывные самовоспламеняющиеся аноды Содерберга представляют собой брикеты коксо-солевой пасты, которые вставляются в стальную оболочку электрода сверху. При горении дна брикеты опускаются на дно и сгорают, не достигнув расплавленной ванны. Брикеты содержат различные связующие смолы, которые вносят свою лепту в продукты сгорания. Второй тип, предварительно обожженные аноды, производят меньше выбросов в процессе электролиза. Они формируются из углерода с различными связующими веществами и обжигаются в специальных печах. Подготовленный электрод прикрепляется к держателю анода и погружается в расплавленный металл. При сжигании анод заменяется, а «зола» перерабатывается для изготовления новых анодов из отходов.
Инертные аноды
Расход электродов вызывает множество проблем. Помимо усложнения процесса и увеличения стоимости алюминия, замена электродов также приводит к значительным выбросам углекислого газа и угарного газа. По словам Виктора Манна, инертный анод, который не теряется в процессе электролиза, не горит, не растворяется в расплавленном криолите и не загрязняет получаемый алюминий — это, пожалуй, мечта конструкторов электролизных установок. Это могут быть керамические аноды на основе оксидов различных металлов (железа, никеля, меди и т.д.), которые абсолютно инертны к электролиту и алюминию, но трудно свариваются (поэтому их довольно сложно снабжать электричеством). Другой подход заключается в использовании специальных металлических сплавов (железо, медь и т.д.), которые более технологичны, но могут вступать в реакцию с алюминием, в результате чего образуется определенное количество примесей.
«Мы уже совсем близко, такие аноды сейчас проходят испытания, и я надеюсь, что в ближайшие годы они войдут в производство заводов РУСАЛа, — говорит Виктор Манн, — Инертные аноды не требуют замены существующих электролитов на горизонтальные аноды». Однако если говорить о будущем и о конструкции именно для инертных анодов, то можно ожидать перехода к другой схеме — набору из нескольких чередующихся вертикальных анодов и катодов. Такая конфигурация значительно увеличит мощность и эффективность процесса электролиза. Однако здесь, очевидно, потребуются новые решения. Предположим, что в обычной системе с горизонтальными анодами расстояние между электродами просто регулируется путем опускания анода. Однако регулировка расстояния между вертикальными электродами конструктивно более сложна. Кроме того, использование тепла становится более сложным. Но преимущества того стоят. Аэрокосмическая, автомобильная, строительная и электротехническая отрасли нуждаются во все большем количестве алюминиевых сплавов, поэтому будущее за этим металлом.